Descubre los estados alotrópicos más fascinantes: Guía completa y detallada
¿Qué son los estados alotrópicos y cuáles son sus propiedades?
Los estados alotrópicos son diferentes formas en las que un elemento químico puede existir en su estado sólido, líquido o gaseoso. Estas diferentes formas, llamadas alotropías, poseen distintas estructuras cristalinas y propiedades físicas y químicas.
La existencia de varios estados alotrópicos para un mismo elemento se debe a las variaciones en la disposición de los átomos en la estructura de su materia. Esto puede dar lugar a diferencias en la densidad, la conductividad eléctrica, el punto de fusión y ebullición, entre otras propiedades.
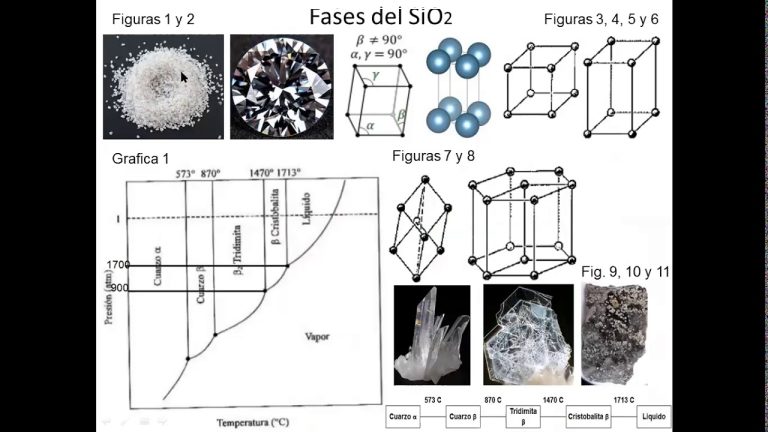
Un ejemplo conocido de un elemento con varios estados alotrópicos es el carbono. En su forma más común, el carbono se encuentra en estructuras cristalinas denominadas grafito y diamante. El grafito es un sólido negro y brillante, mientras que el diamante es transparente y extremadamente duro.
Además del grafito y el diamante, el carbono también puede existir en otras formas alotrópicas, como los fullerenos y los nanotubos de carbono. Estas estructuras poseen propiedades únicas y han encontrado aplicaciones en campos tan diversos como la electrónica, la biomedicina y la ingeniería de materiales.
En resumen, los estados alotrópicos son diferentes formas en las que un elemento puede existir, cada una con sus propias propiedades físicas y químicas. La comprensión de estos estados alotrópicos es fundamental para entender las características y aplicaciones de los elementos químicos en diferentes contextos.
Descubre los distintos estados alotrópicos de la materia
Los estados alotrópicos de la materia son diferentes formas en las que un elemento químico puede existir en condiciones específicas. Ciertos elementos pueden tener múltiples formas alotrópicas, lo que significa que sus átomos pueden unirse de manera diferente para formar estructuras distintas.
Un ejemplo prominente de esto es el carbono, que puede existir en forma de diamante, grafito o fullereno. Cada una de estas formas tiene propiedades físicas y químicas únicas. El diamante es conocido por su dureza y su capacidad de brillar, mientras que el grafito es suave y se utiliza en lápices. Los fullereno, por otro lado, tienen una estructura de fútbol molecular y son utilizados en aplicaciones tecnológicas avanzadas.
Otros elementos que muestran diferentes estados alotrópicos incluyen el oxígeno, con formas como el oxígeno molecular (O2) y el ozono (O3), y el fósforo, que puede existir como blanco o rojo, cada uno con propiedades distintivas.
Estudiar los distintos estados alotrópicos de la materia es importante para comprender cómo los elementos pueden interactuar y cómo sus propiedades pueden variar según su estructura. Esto es fundamental tanto en la química como en la ciencia de los materiales, y nos ayuda a explorar nuevas aplicaciones y tecnologías.
Conoce los ejemplos más relevantes de estados alotrópicos
Los estados alotrópicos son diferentes formas en las que un elemento químico puede existir físicamente. Estas variedades tienen estructuras atómicas o moleculares distintas, lo que les confiere diferentes propiedades y comportamientos. Es interesante conocer algunos ejemplos relevantes de estados alotrópicos para comprender mejor la versatilidad de los elementos en la naturaleza.
Uno de los ejemplos más conocidos de un estado alotrópico es el carbono. Este elemento puede presentarse en diferentes formas, como el grafito, el diamante y el fullereno. El grafito es suave y tiene una estructura de capas de átomos de carbono unidos, lo que le confiere una excelente conductividad eléctrica. Por otro lado, el diamante es extremadamente duro y transparente, debido a su estructura cristalina. El fullereno, por su parte, tiene una forma de balón de fútbol y es muy utilizado en la investigación científica.
Otro ejemplo relevante de estados alotrópicos es el oxígeno. En condiciones normales, el oxígeno existe en forma de moléculas diatómicas (O2), pero bajo ciertas condiciones puede transformarse en ozono (O3). El ozono es muy reactivo y se utiliza en la desinfección del agua y el aire debido a su capacidad para destruir microorganismos y neutralizar olores desagradables. Además, el oxígeno líquido es otro estado alotrópico que se utiliza en la industria y en aplicaciones médicas debido a su capacidad para mantener bajas temperaturas.
El azufre es otro elemento que presenta distintos estados alotrópicos. Su forma más común es el azufre rómbico, que tiene un color amarillo y es el estado estable a temperatura ambiente. Sin embargo, el azufre también puede existir en forma de azufre monoclinico o azufre plástico. Estos estados alotrópicos son menos comunes y se obtienen mediante procesos de calentamiento y enfriamiento controlados.
Como podemos ver, los estados alotrópicos son una faceta fascinante de la química y la física de los elementos. Estos ejemplos nos muestran cómo un mismo elemento puede exhibir propiedades y comportamientos completamente diferentes según la estructura y el arreglo de sus átomos o moléculas.
¿Por qué los estados alotrópicos son importantes en química?
Los estados alotrópicos son particularmente relevantes en el campo de la química debido a su capacidad para influir en las propiedades físicas y químicas de los elementos. Esta fenomenología se refiere a la existencia de distintas estructuras cristalinas o moleculares de un mismo elemento en condiciones normales. Estas diferentes formas alotrópicas presentan propiedades y comportamientos distintos, lo que permite su aplicación en una amplia gama de áreas de estudio y aplicaciones industriales.
En primer lugar, los estados alotrópicos desempeñan un papel crucial en la comprensión de las propiedades de los elementos químicos y su comportamiento bajo diferentes condiciones de temperatura y presión. Esta variabilidad alotrópica se manifiesta en cambios en la estructura de los átomos o moléculas, lo que a su vez puede afectar la solubilidad, la dureza, la densidad y la conductividad eléctrica y térmica de los materiales.
Además, la capacidad de los elementos para existir en diferentes estados alotrópicos permite su utilización en aplicaciones prácticas de importancia científica y tecnológica. Por ejemplo, el carbono puede presentarse en formas alotrópicas como el diamante, el grafito y el fullereno, y cada una de estas estructuras posee propiedades únicas, lo que posibilita su uso en diversas áreas, como la fabricación de joyería, la producción de lápices y como materiales de alta tecnología en la industria.
Por último, el estudio de los estados alotrópicos también es fundamental en el análisis de reacciones químicas y la comprensión de la transformación de los compuestos. Las variaciones en la estructura alotrópica pueden influir en la estabilidad y la reactividad de los elementos, lo que ayuda a los químicos a comprender mejor los mecanismos de las reacciones y a diseñar nuevos catalizadores y materiales con aplicaciones específicas.
En conclusión, los estados alotrópicos son de gran importancia en el campo de la química debido a su capacidad para influir en las propiedades y comportamientos de los elementos. El estudio de estas diferentes formas alotrópicas permite una comprensión más profunda de los materiales y su aplicación en diversas áreas, desde la industria hasta la investigación científica.
Aprende cómo se pueden modificar los estados alotrópicos
Los estados alotrópicos se refieren a las diferentes formas en las que un elemento químico puede existir en la naturaleza. Algunos elementos pueden presentar más de una forma alotrópica, lo que significa que pueden tener diferentes estructuras y propiedades físicas y químicas.
Modificar los estados alotrópicos de un elemento implica cambiar la forma en la que se organizan sus átomos o moléculas. Esto se puede lograr mediante diferentes métodos, como cambios en la temperatura y presión, adición de otros elementos o compuestos, o mediante procesos químicos específicos.
La modificación de los estados alotrópicos puede tener importantes implicaciones en diferentes industrias y aplicaciones tecnológicas. Por ejemplo, algunos materiales como el carbono pueden existir en formas alotrópicas como el grafito y el diamante, que tienen propiedades muy diferentes. La capacidad de modificar estos estados alotrópicos nos permite obtener materiales con propiedades específicas para diferentes usos, como el uso de diamantes sintéticos en la fabricación de joyería o la utilización de grafito en la fabricación de lápices.
Además de los cambios en las propiedades físicas, la modificación de los estados alotrópicos también puede tener un impacto en las propiedades químicas de un elemento. Por ejemplo, el oxígeno puede existir en forma de oxígeno molecular (O2) o de ozono (O3), y cada forma tiene diferentes reactividades químicas y aplicaciones en la industria.
Contenido